


(c) D. Hassler
Die zeckenübertragenen Viren gehören zu verschiedenen Familien. Die meisten (FSME, RSSE, Louping Ill, Powassan-Encephalitis, Omsker haemorrhagisches Fieber und Kyasanur-Waldkrankheit) gehören zu den Flaviviren. Flaviviren sind recht vielfältig, die prominentesten Vertreter wie Gelbfieber und Dengue werden von Stechmücken übertragen, das Hepatitis-C-Virus dagegen über Blutprodukte oder sexuell.
Das Krim-Kongo-Fieber gehört in die Gruppe Nairoviren aus der Familie der Bunyaviren, zu denen auch die Hantaviren gehören. Während das Krim-Kongo-Fieber durch Zecken übertragen wird, werden Hantaviren meist als Aerosol mit Staub verbreitet. Andere Vertreter der Bunyaviren, die Phleboviren, setzen dagegen auf Stechmücken als Vektoren.
Das Colorado-Zeckenfieber gehört in die Familie Reoviren, zu denen auch das als Erreger von Darminfektionen bekannte Rotavirus zählt.
Daneben gibt es noch einige seltene Erreger, zum Beispiel das in Deutschland isolierte Tettnang-Virus aus der Familie der Iridoviren.
Die russische Variante der Zecken-Encephalitis, als RSSE oder RTBE bezeichnet, ähnelt unserer FSME stark, verläuft jedoch meist schwerer. Erreger ist ein mit der FSME nahe verwandtes Flavivirus. Die Krankheit wurde erstmalig 1932 im Gebiet der ehemaligen UdSSR beschrieben. Zwei Formen sind beschrieben, die westlicher Variante im Ural und in angrenzenden Gebieten sowie eine fernöstliche Variante.
Hauptreservoire sind Mäusearten wie Rötel- und Gelbhalsmäuse, Überträger sind hauptsächlich Ixodes-Zecken (in den wetslicheren Gebieten meist Ixodes ricinus , im Ostsibirischen Endemiegebiet Ixodes persulcatus.
Nach einer Inkubationszeit von 10-14 Tagen tritt hohes Fieber auf. Kopfschmerzen, Schwindel und Erbrechen sind häufig, bereits wenige Tage nach Fieberbeginn ist mit neurologischen Komplikationen und Lähmungen zu rechnen. Die Erkrankung ist also weniger deutlich zweiphasig als die FSME. Die Impfung gegen FSME bietet auch gegen die RSSE einen guten Schutz.
Die Powassan-Encephalitis ist eine nahe verwandte Krankheit, die in Kanada vorkommt. Vektor ist hier Ixodes cookei, das Krankheitsbild entspricht der RSSE.
Schon seit vielen Jahrzehnten ist bei den Schafhaltern in Großbritannien eine epidemisch auftretende Erkrankung der Schafe bekannt, die als Louping-ill-disease bezeichnet wurde. Erst in neuerer Zeit erkannte man, daß auch andere Haustiere, Vögel und Menschen empfänglich sind.
Der Erreger der LID ist ein Flavivirus, das relativ eng mit den anderen Vertretern wie FSME und RSSE verwandt ist. Es wird in England ausschließlich von Zecken der Gattung Ixodes übertragen. Die Zecken nehmen den Erreger beim Saugen auf infizierten Tieren auf und geben ihnbei der nächsten Blutmahlzeit weiter. In Endemiegebieten sind etwa 0,1—0,4% der Zecken infiziert.
Bei Schafen beginnt die Erkrankung nach einer Inkubationszeit von 6-18 Tagen mit Fieber und Nahrungsverweigerung. Das Fieber hält etwa fünf Tage an, in dieser Phase beginnen die neurologischen Störungen mit Gangunsicherheit, Zittern und Koordinationsstörungen. Oft können die Schafe sich nicht mehr richtig auf den Beinen halten und torkeln. Grund ist eine Entzündung des Gehirns der Tiere (Encephalitis). Oft verläuft die Krankheit bereits in dieser Phase tödlich, gelegentlich werden aber auch Verläufe über mehrere Wochen beobachtet. Beim Menschen macht die LID eine schwere Erkrankung mit Fieber und Encephalitis, die gewisse Ähnlichkeiten zur FSME aufweist. Bisher sind hauptsächlich Menschen betroffen gewesen, die Umgang mit erkrankten Tieren hatten, verschiedentlich aber auch Labormitarbeiter, die mit dem Virus arbeiteten.
Die Diagnose wird bei Tieren meist aufgrund der typischen Symptome gestellt, es stehen aber auch serologische Verfahren zur Verfügung.
Eine formalininaktivierte Impfung steht für Tiere zur Verfügung. Sie bietet eine hohen Schutz. Eine kausale Therapie existiert nicht.
In den Jahren des zweiten Weltkrieges trat eine große Epidemie in Westsibirien auf, die damals nicht ganz sicher von anderen Erkrankungen wie Tularämie und Rickettsientyphus unterschieden werden konnte. 1946 wurde schließlich das OHF-Virus, ein Flavivirus, isoliert.
Das OHF-Virus ist ein Flavivirus, das sehr nahe mit dem FSME-Virus verwandt ist. Im Gegensatz zu diesem vermehrt sich das OHF-Virus aber hauptsächlich in den Endothelzellen der Gefäße, weshalb es häufiger Blutungskomplikationen macht. Reservoire scheinen verschiedene Wühlmausarten zu sein, die Übertragung geschieht in der Regel durch Zecken der Gattung Dermacentor und Ixodes.
Die Infektion führt in verschiedenen Wirtstieren zu völlig unterschiedlichen Krankheitsbildern. In Mäusen und Hamstern kommt es zu einer tödlich verlaufenden Encephalitis, Kaninchen und Hasen erkranken dagegen klinisch überhaupt nicht. Die Zibetkatze und der Mensch dagegen entwickeln ein haemorrhagisches Fieber.
Beim Menschen kommt es nach einer Inkubationszeit von nur 2-4 Tagen zu einem hochfieberhaften Krankheitsbild mit Kopf- und Muskelschmerzen und einer Verminderung der weißen Blutkörperchen. Die Fieberphase dauert meist etwa 5-12 Tage, bereits in dieser Phase treten Blutungskomplikationen auf (am häufigsten Nasenbluten). Fast alle Patienten erholen sich aber ohne Folgeschäden.
Die KFD wurde erstmals in den Jahren 1955-57 in einem Waldbezirk an der Südwestküste Indiens entdeckt. Damals erkrankten und starben zunächst zahlreiche Affen, dann auch Menschen. Zunächst hielt man die Erkrankung für eine Variante der Russischen Zeckenencephalitis, erst 1990 wurde erkannt, daß es sich um eine eigene, unabhängige Krankheit handelt. In den letzten Jahrzehnten scheint die Zahl der Erkrankungen eher zuzunehmen, etwa 500 Fälle werden jährlich im Endemiegebiet beobachtet.
Der Erreger der KFD ist ein Flavivirus, also mit unserer FSME und vielen Tropenkrankheiten verwandt. Das Virus wurde aus Zecken verschiedener Arten isoliert, Hauptüberträger ist aber die Zecke Haemophysalis spinigera. Betroffen von der Erkrankung sind neben Affen und Menschen auch verschiedene Kleinsäuger, das definitive Reservoir ist aber noch nicht bekannt. Die Zecken selbst kommen als Reservoir nicht in Betracht, da das Virus nicht über die Zeckeneier weitergegeben wird.
Nach einer Inkubationszeit von nur 2-7 Tagen tritt hohes Fieber, verbunden mit Kopf- und Gliederschmerzen auf. Das Fieber hält mit einer durchschnittlichen Dauer von 12 Tagen ungewöhnlich lange an, schwere Muskelschmerzen, Erbrechen und Durchfälle komplizieren den Verlauf. Manchmal werden auch zweiphasige Verläufe mit einem erneuten Fieberanstieg und neurologischen Störungen wie Verwirrtheit in der dritten und vierten Krankheitswoche beobachtet. Blutungskomplikationen sind selten. Die Letalität liegt bei ca. 10%, wobei in diesen Fällen meist ein Lungenödem die Ursache war.
Eine spezifische Therapie existiert nicht, ebensowenig eine wirksame Impfung. Aus theoretischen Gründen hatte man erwartet, daß die FSME-Impfung vielleicht einen partiellen Schutz bieten könnte, da die Viren nahe verwandt sind. Im Tierversuch ließ sich allerdings kein Schutz realisieren.
Das Krim-Kongo Fieber ist in Asien und Afrika weit verbreitet, kommt jedoch auch in Südost-Europa auf dem Balkan (ehem. Jugoslawien, Albanien, Griechenland), sowie im Mittleren Osten vor. Eine Übertragung erfolgt sowohl durch Zecken der Gattung Hyalomma, als auch häufig sekundär auf Familienmitglieder und Ärzte. Erregerreservoir sind neben den Zecken selbst vor allem Huftiere. Das Virus besitzt eine Hülle, eine segmentierte Einzelstrang-RNA und gehört zur Gruppe der Nairoviren aus der Familie der Bunyaviren.
Die Inkubationszeit der Infektion beträgt nach Zeckenstich 3-12 Tage, bei nosokomialer Infektion 3-6 Tage. Der Manifestationsindex ist relativ gering und wird mit 5% angenommen. Die Erkrankung beginnt meist abrupt mit Grippe-ähnlichen Symptomen, Kopf- und Gliederschmerzen, Übelkeit und Photophobie. Petechien treten bereits früh auf, ab dem 3. Tag könne Hämorrhagien hinzutreten. Das zusätzliche Auftreten von ZNS-Symptomen ist mit einer ungünstigen Prognose verknüpft. Unbehandelt verläuft die Erkrankung über 1 bis 2 Wochen, jedoch mit sehr langsamer Konvaleszenz. Die Letalität ist der manifesten Infektion ist jedoch hoch und beträgt in Abhängigkeit vom Virusstamm 15-50%.
Wichtig ist die frühzeitige Therapie mit Ribavirin, weshalb die rasche Diagnose ausschlaggebend ist. Ebenso müssen Patienten aufgrund der hohen Übertragungsrate von Mensch zu Mensch streng isoliert werden. Die Akutdiagnostik erfolgt am raschesten durch PCR aus dem Blut.
Geschichte
Das Colorado-Zecken-Fieber wurde 1930 beschrieben. Die Übertragung durch Dermacentor-Zecken wurde in den vierziger Jahren aufgeklärt.
Der Erreger
Das Coltivirus gehört zu den Reoviren. Ein nahe verwandtes Virus, das Eyach-Virus, wurde 1976 in Baden-Württemberg in Zecken gefunden. Ob es auch für menschliche Erkrankungen verantwortlich ist, ist bisher völlig unbekannt. Klinische Verläufe mancher Patienten, die nach Zeckenstich ein hochfieberhaftes Krankheitsbild entwickeln, ohne daß sich Antikörper gegen FSME oder Borrelien nachweisen lassen, sollten unsere Aufmerksamkeit auf diesen Erreger lenken. Leider existieren in Deutschland bisher keine serologischen Verfahren, um Antikörper gegen Eyach- oder Coltivirus nachzuweisen.

Zahlreiche Arten von Säugetieren, vor allem kleine Nager, aber auch Huftiere, fungieren als Reservoir. Hauptüberträger in Amerika ist Dermacentor andersoni, das Virus wurde aber auch schon aus anderen Dermacentor- und Haemaphysalis-Arten isoliert. Die Zeckendurchseuchung mit Coltivirus kann in manchen Endemiegebieten der Rocky Mountains bis zu 10% betragen. Warum menschliche Erkrankungen angesichts dieser Häufigkeit des Virus in Zecken eher selten sind, ist bisher ungeklärt. Eine Rolle spielt aber sicher, daß Dermacentor-Arten, die auch in Deutschland vorkommen, Menschen eher selten befallen.
Nach nur 2-5 Tagen treten Fieber, Kopf- und Gliederschmerzen auf, die in dieser Phase keine Unterscheidung von anderen Virus-Infektionen zulassen. Die initiale Fieberphase dauert in der Regel wenige Tage, dann kommt es zu einem freien Intervall, bei etwa der Hälfte der Erkrankten gefolgt von einer zweiten, schwereren Krankheitsphase. In einem Teil der Fälle wurden auch Komplikationen wie Hirnhaut-, Hoden- und Herzmuskelentzündungen, manchmal auch Blutungen aus dem Magen-Darmtrakt beobachtet. Die erkrankung führt nur sehr selten zum Tod (weniger als 0,2%).
Eine Verminderung der weißen Blutkörperchen in der akuten Phase der Erkrankung ist die Regel, Verminderungen der Blutplättchen und Gerinnungsstörungen kommen vor. Serologische Tests und PCR-Nachweismethoden wurden entwickelt, werden aber bisher in Deutschland nicht in der Routine angeboten.
Bisher existiert weder eine Impfung noch eine kausale Therapie.
Geschichte
Neben der Pest gibt es eine weitere Erkrankung, die in historischer Zeit nach Meinung mancher Autoren mehr Tote als alle Weltkriege zusammen verschuldet hat: Der Flecktyphus, ausgelöst von Rickettsia prowazekii, war verantwortlich für riesige Epidemien, die unter anderem in den napoleonischen Feldzügen gegen Rußland kriegsentscheidende Bedeutung hatten, da von einer halben Million Soldaten auf dem Rückzug schließlich nur noch etwa 2000 einsatzfähig waren. Fast alle Toten gingen auf das Konto des Flecktyphus. Diese Erkrankung wird von Kleiderläusen übertragen, wogegen die meisten anderen Rickettsienarten sich verschiedener Zecken als Vektoren bedienen. Folgerichtig ist der Flecktyphus mit dem weitgehenden Verschwinden der Läuse selten geworden, die zeckenübertragenen Rickettsien dagegen unverändert häufig geblieben.
Rickettsien sind obligat intrazellulär lebende, gramnegative Bakterien. Sie werden, nicht zuletzt aus historischen Gründen, in drei Gruppen eingeteilt: Die "Typhus-Gruppe" mit dem prominentesten, bereits erwähnten Vertreter Rickettsia prowazekii, Erreger des Flecktyphus, die "spotted-Fever-Gruppe", deren bekanntester Vertreter Rickettsia rickettsii , der Erreger des Rocky-Mountain-Spotted-Fever ist, und eine dritte Gruppe, zu der nur Rickettsia tsutsugamushi, der Erreger des Scrub-Typhus gehört. Diese Art wird, soweit bekannt als einzige, von Milben verbreitet. Zahlreiche Rickettsienarten wurden weltweit in Zecken gefunden und mit menschlichen Erkrankungen in Verbindung gebracht (siehe Tabelle). Andere wurden bisher nur aus Zecken isoliert, aber bisher noch nicht mit Krankheiten assoziiert.
Das Altweltzeckenfieber, im englischen Sprachraum "Mediterranean spotted fever" (MSF) genannt, kommt rund um das Mittelmeer und rund um das schwarze Meer vor. Es wurde 1909 in Tunesien von Conor beschrieben. Der Erreger, Rickettsia conori, trägt seinen Namen. Überträger sind Zecken, meist Rhipicephalus-Arten (deutscher Name: Braune Zecken). Typischerweise findet man an der Zeckenstichstelle nach Tagen ein (nicht immer) blauschwarz belegtes kleines Geschwür, die "Tache noire", die manchmal von einem Hautausschlag umgeben (siehe Abb.) ist. Später tritt hohes Fieber, zusammen mit Muskelschmerzen und starken Kopfschmerzen auf, dann folgt ein generalisierter Hautausschlag.
Hautbefund bei MSF: Eine 16-jährige Patientin erlitt anläßlich eines Zeltlagers in der Toskana im Juli 1998 einen Zeckenstich. 14 Tage später zeigt sich das typische Bild der (noch lokal begrenzten) R. conori-Infektion (Mittelmeerfleckfieber) mit zentralem Geschwür und umgebendem Hautsausschlag. Generalisationssymptome bestanden noch nicht. Die 20-tägige Therapie mit Doxycyclin führte zur vollständigen Ausheilung.
Bei etwa 6% der registrierten MSF-Fälle treten schwere Verläufe auf, 2% der Patienten sterben. Als Komplikation kann unter anderem eine interstitielle Nephritis auftreten. 1999 kam es zu einer großen Epidemie in Süditalien, bei der mehrere Patienten verstorben sind.
Das RMSF wurde vor etwa hundert Jahren in den USA erstmals als "black measles" beschrieben. Ricketts, einer der Pioniere auf dem Gebiet der Rickettsienforschung, konnte bereits Anfang dieses Jahrhunderts nachweisen, daß das Rocky Mountain spotted fever auf Meerschweinchen übertragbar war. Bereits zu dieser Zeit war Dermacentor andersoni, eine amerikanische Zeckenart, als Quelle der Erkrankung in der Diskussion. Heute wissen wir, daß auch andere Zeckenarten wie Haemaphysalis- und Ixodes
| Krankheitsbild | Art | Vektor | Verlauf | Verbreitung |
|---|---|---|---|---|
| Flecktyphus | R.prowazekii | Kleiderlaus | schwer, Rezid. häufig | früher weltweit, heute Afrika |
| muriner Typhus | R.typhi | Rattenflöhe | eher mild | weltweit |
| Rickettsienpocke n | R. akari | Mäuse-Milben (Allodermanyssus sp.) | mild | New York, verm. weltweit |
| MSF, Altweltzeckenfie ber | R. conorii | gelegentlic h schwer | Mittelmeer, Afrika, Vorderasien | |
| Israeli spotted fever | Rhipicephalus-Zec ken | schwer | Naher Osten | |
| RMSF, Rocky Mountain spotted fever | R.rickettsii | Dermacentor und andere Zecken | schwer, teilweise letal | Amerika |
| Californische Flohrickettsiose | R. felis | Rattenflöhe | ? | Westküste USA |
| Scrub typhus Tsutsugamushi-F. | Orientia tsutsugamu shi | Ernte-Milben (Thrombidien) | schwer, teilweise letal | Ost/Südostasi en |
| Oriental spotted fever | R. japonica | Haemaphysalis- Zecken | schwer | Japan |
| Sibirischer Zeckentyphus | R. sibirica | Zecken | Russland, Pakistan | |
| Astrakhan fever | unbenannte Art | Rhipicephalus-Zec ken | weniger schwer | südl. Russland |
| Südafrikanische s Zeckenfieber | R. africae | Amblyomma- Zecke n | schwer | Südafrika |
| Queensland tick typhus (QTT) | R. australis | Ixodes- Zecken | weniger schwer | Australien |
| Flinder Island spotted fever (FISF) | R. honei | Flinder Island bei Australien | ||
| ? | R. slovaca | Dermacentor -Zeck en | EM-artige Hautläsion | Tschechien, Schweiz, Frankreich |
| ? | R. massiliae | Rhipicephalus-Zec ken | ? | |
| ? | R. helvetica | Ixodes ricinus-Zecken | ? |
Geschichte:
1937 wurde das Q-Fieber von Derrick erstmals in Australien als klinische Entität beschrieben. In der Folge wurden Q-Fieber-Fälle aus fast allen Ländern der Welt mit Ausnahme von Neuseeland bekannt. Größere Epidemien wurden in Bulgarien in den neunziger Jahren beobachtet, nachdem vermehrt Ziegen gehalten wurden. Dieser Zusammenhang mit der Haltung bzw. Verarbeitung von Schafen oder Ziegen besteht praktisch immer. In Deutschland sind in den letzten Jahren etwa zehn größere Ausbrüche beobachtet worden. Da die Erkrankung keine absolut typischen Symptome zeigt, kommt es immer wieder zu Verzögerungen bei der Diagnosestellung.
In den Jahren 1998 und 1999 sind in Baden-Württemberg mehrere größere Ausbrüche von Q-Fieber aufgetreten. Dies begann im Mai bis Juli 1998, wo mehr als 100 Erkrankungen in Freiburg beobachtet wurden. Als Zentrum der Epiedemie konnte das Gelände des alten Flugplatzes eingegrenzt werden, das gelegentlich zur Schafbeweidung genutzt wird.
Im August und September 1999 trat die Erkrankung im Gebiet von Rottweil und der schwäbischen Alb auf. Auch für diese Fälle konnten Schafskontakte als Ursache wahrscheinlich gemacht werden. In Rottweil hatten Schafe ihre Kälber auf Weiden geboren, durch die Wanderwege führen, in Stetten gab es eine Festveranstaltung mit Schafschur. Möglicherweise war die lang anhaltende Trockenheit ein wesentlicher Faktor, da es so zu einer verstärkten Aerosolbildung bzw. Staubentwicklung kam.
Coxiella burnetii ist ein obligat intrazellulär lebender Erreger, der zu den Rickettsien gehört, wegen einiger grundsätzlich anderer Eigenschaften aber in eine eigene Gattung gestellt wurde. Eine auffallende Besonderheit von Coxiella ist die sehr hohe Resistenz gegen Austrocknung und Lichtexposition, weshalb noch nach Monaten sekundäre Infektionen, vor allem durch Aerosole möglich sind.
Primäre Überträger des Q-Fiebers sind in Europa Zecken der Gattung Dermacentor, die den langfristigen Infektionszyklus unterhalten. Nach Infektion von Ziegen oder Schafen gibt es mehrere Wege der Weiterverbreitung: infektiöser Zeckenkot kann in der Schafwolle zurückbleiben und per Aerosol weitere Infektionen verursachen oder die Infektion kann über die Milch erkrankter Tiere weitergegeben werden. In der Praxis wohl am häufigsten ist der dritte Weg: Die Infektion führt beim trächtigen Muttertier zu einer Placentitis mit sehr hohen Keimzahlen im plazentaren Gewebe. Bleibt die Nachgeburt im Gelände liegen, kann nach Austrocknung ein hochinfektiöses Aerosol entstehen. Das Aufwirbel des Staubs reicht dann oft schon aus, um den Erreger zu übertragen. Coxiella ist hochinfektiös, einige wenige Erreger genügen bereits.
Zwei klinische Varianten sind bekannt: Die akute und die chronische Form des Q-Fieber. Bei der akuten Form kommt es nach Aerosolübertragung (sehr selten nach Zeckenstich oder Genuß infizierter Milch) mit einer Inkubationszeit von ca. 20 Tagen in vielen Fällen nur zu einem milden, mehr oder weniger fieberhaften Infekt, in manchen Fällen aber auch zu einem hochfieberhaften Krankheitsbild mit Kopf- und Gliederschmerzen, häufig begleitet von einer atypischen Pneumonie. Komplikationen sind nicht selten, neben einer granulomatösen Hepatitis können Myo-pericarditiden (Entzündungen des Herzmuskels bzw. des Herzbeutels) und Meningitiden (Hirnhautentzündungen) auftreten. Die chronische Form führt häufig zu Endocarditiden (Herzklappenentzündungen), die nach einer Latenz von 3-20 Jahren beobachtet wurden.
Da eindeutige Symptome fehlen und die radiologische Diagnose einer atypischen Pneumonie viele Differentialdiagnosen beinhaltet, kann die endgültige Diagnose meist nur serologisch gestellt werden. Hierfür finden zwei Antigene Verwendung: Bei der frischen Infektion werden zunächst Antikörper gegen das Phase II-Antigen gebildet, dann folgen im weiteren Krankheitsverlauf (in der KBR nach etwa 10 Wochen) Antikörper gegen das Phase I-Antigen. Beide können mit KBR oder Immunfluoreszenztest nachgewiesen werden.
Das Q-Fieber wird in der Regel mit Tetracyclinderivaten, heute in der Regel Doxycyclin (200 mg/20 Tage) behandelt. Bei der chronischen Form reicht dies nicht aus, in diesem Fall muß über mehrere Monate bis Jahre mit einer Kombination aus Doxycyclin und Rifampicin oder Trimethoprim/Sulmethoxazol behandelt werden. In vitro sind auch moderne Makrolide und Gyrasehemmer wirksam, kontrollierte Studien zu diesen Präparaten existtieren aber noch nicht.
Geschichte
Der Erreger, der heute Francisella tularensis genannt wird, wurde erstmals 1912 im Tulare-County (Kalifornien) aus Körpermaterial verendeter Ground Squirrels, einer Art Eichhörnchen, isoliert. E. Francis entdeckte die Zusammenhänge zwischen den Erkrankungen bei Nagern und einer damals als "Deer Fly Fever" bezeichneten Erkrankung bei Menschen.
In Schweden wurde die Tularämie 1931 erstmals beschrieben. Hier existiert ein natürliches Verbreitungsgebiet am Rande der baltischen See in Mittelschweden. Immer wieder kam es hier zu großen Ausbrüchen, die teilweise epidemischen Charakter annahmen. Allein 1966/67 erkrankten mehrere Tausend Menschen. In Rußland wurden sogar Epidemien mit mehr als hunderttausend Erkrankungen während des zweiten Weltkrieges beobachtet.
Francisella tularensis ist ein gramnegatives rundliches Bakterium, das in der Regel nur in Cystein-haltigen Medien oder intrazellulär gut wächst. Aus diesem Grund kann es bei Verwendung üblicher Blutkulturmedien übersehen werden. Zwei Varianten (Typ A und B) sind bekannt. Typ A (Biovar tularensis) kommt nur in Nordamerika vor und ist für wesentlich aggressivere Krankheitsverläufe verantwortlich als der weltweit vorkommende Typ B (Biovar paläarctica). Hauptreservoir für beide Typen sind Wild-Hasen und andere Nager.
Mehrere Übertragungswege sind bekannt. Der erste ist der unmittelbare Kontakt mit Blut infizierter Tiere, etwa beim Schlachten von Wildhasen. In diesen Fällen ist die Inkubationszeit oft sehr kurz (2-5 Tage), da es zu einer primären Sepsis kommt. Auch der Genuß einer unzureichend erhitzten Hasenmahlzeit kann zur Infektion führen. Auch Kuhmilch wurde für einen Ausbruch verantwortlich gemacht, wobei der Infektionsmodus nicht geklärt werden konnte.
eine Abbildung eines Ulkus (Finger) bei Tularämie gibts bei der CDC/Atlanta: www.cdc.gov
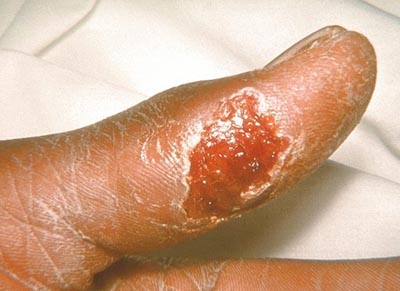
Der andere wesentliche Weg ist die Übertragung durch Zecken (vorwiegend der Gattung Dermacentor, seltener auch durch Ixodes-Zecken) und Stechmücken. In einer Untersuchung an Dermacentor-Zecken in Tschechien wurden durchschnittlich 2.8% infizierte Zecken gefunden. Da es bei dieser Variante zur Übertragung viel geringerer Erregerzahlen kommt, ist die Inkubationszeit meist länger (6-30 Tage).
Ein dritter Infektionsmodus konnte in Schweden für den größten Ausbruch in den Jahren 1966/67 wahrscheinlich gemacht werden: die Inhalation erregerhaltigen Materials. 1966 war es zu einem massenhaften Sterben von Nagern gekommen, und viele dieser Nager starben in Feldscheunen. Die Kadaver lagen oft im Heu, und beim Umsetzen und Verladen des Heus kam es zur Bildung eines hochinfektiösen Aerosols, das nach Einatmung meist eine primär pneumonische Verlaufsform auslöste.
Die Tularämie ist aus vielen Ländern, vor allem der nördlichen Hemisphäre, bekannt, aber nicht häufig. Die meisten Fälle traten sporadisch auf, immer wieder wurden kleinere Serien berichtet, große Epidemien gab es nur selten. In Nordamerika rechnet man mit etwa 1500 Erkrankungen pro Jahr, in Skandinavien sind es einige Dutzend, in Tschechien und der Slowakei etwa je 10. Die Dunkelziffer dürfte aber wegen der Schwierigkeiten der Diagnose und der Vielfalt der Symptome erheblich sein.
In Europa existieren mehrere Endemiegebiete, dazu gehören ganz Skandinavien und Westrußland, die Tschechoslowakei und Teile Österreichs. Daten aus Deutschland fehlen (wieder einmal!) praktisch völlig. Japan meldete bisher insgesamt 1400 Erkrankungen in sieben Jahrzehnten.
Die Tularämie zeigt einen auffällig großen Variantenreichtum im klinischen Verlauf. Bei Übertragung durch Zecken- oder Mückenstich entsteht an der Stichstelle oft ein typisches, wie ausgestanzt wirkendes, schlechtheilendes Geschwür. Danach kommt es nach lymphogener Ausbreitung zu lokoregionären Lymphknotenschwellungen ("ulzeroglanduläre Form "). Bei Schmierinfektion über die Eintrittspforte Auge nach direktem Kontakt mit Sekreten infizierter Tiere tritt eine sehr schmerzhafte Konjunktivitis mit Lymphknotenschwellungen auf ("okuloglanduläre Form ").
Die eher seltene "intestinale Form", bei der der Infektionsweg offensichtlich über den Magen-Darmtrakt (unzureichend erhitztes Fleisch infizierter Tiere) verläuft, zeigt als Leitsymptome eine Rachenentzündung, Erbrechen, Leibschmerzen und Durchfälle. Die primär pneumonische Form ist selten und entsteht nach Inhalation erregerhaltigen Materials.
Die septische Verlaufsvariante, die besonders häufig nach Kontakt mit Blut infizierter Tiere beobachtet wird, wurde früher als "typhoide Form " bezeichnet. Kopfschmerzen, Schweißausbrüche und hohes Fieber sind obligat, als Komplikationen wurden Hirnhautentzündung, Entzündungen des Herzbeutels und Knochenmarkentzündungen beschrieben, eine Entzündung der Skelettmuskulatur im Rahmen der Infektion kann zu einer Beeinträchtigung der Nierenfunktion führen (nur beim Typ A).
Der Erreger kann aus verschiedenen Körpermaterialien (Abstriche aus dem Primärulcus, Punktionsmaterial wie Pleuraexsudate oder Knochenmarksaspirate) angezüchtet werden. Die klassischen serologischen Verfahren verlieren dagegen eher an Bedeutung, da erst der Titeranstieg beweisend ist, was für die Therapieentscheidung natürlich wesentlich zu spät kommt.
Differentialdiagnostisch müssen vor allem Rickettsiosen bedacht werden, da das Primärulcus bei einer Tularämie mit der Tache noire bei Rickettsiosen stark ähneln kann. Auch die septische Form ist durchaus ähnlich.
Bereits lange vor der Lyme-Borreliose waren mehrere andere Borrelienarten bekannt, die für untereinander sehr ähnliche Krankheitsbilder verantwortlich sind. Man fasst diese unter dem Begriff Zecken-Rückfallfieber (im Unterschied zum Läuse-Rückfallfieber, welches als einzige Art durch Kleiderläuse übertragen wird) zusammen.
Die erste wissenschaftliche Beschreibung stammt von Craigie aus dem Jahre 1843. Ihm war aufgefallen, daß diese Erkrankung in typischen Zyklen verläuft, daß die Patienten jeweils Fieberschübe erlitten, zwischen diesen Schüben aber relativ beschwerdefrei waren. Dutton und Todd konnten 1905 erstmals die verantwortlichen Spirochäten in Zecken nachweisen, so daß die Übertragung durch Weichzecken der Gattung Ornithodorus ab dieser Zeit bekannt war. Im Laufe der Zeit wurde in vielen Gegenden der Welt das Zeckenrückfallfieber nachgewiesen.
Rückfallfieber-Borrelien unterscheiden sich nur wenig von den Erregern der Lyme-Borreliose. Sie gehören ebenfalls zu den Spirochäten, schraubenartig gewundenen, etwa 15 µm langen und sehr schmalen Bakterien. Diese sind aktiv beweglich, weil sie an ihrer Außenhaut sogenannte Flagellen tragen. Dies sind membranartige Strukturen, die wie ein Muskel aktiv verkürzt werden können. So kann sich die Borrelie auch im Gewebe aktiv fortbewegen.
Wenn eine Zecke Borrelien mit ihrer Blutmahlzeit aufnimmt, so gelangen diese zunächst in den sogenannten Mitteldarm. Dort vermehren sie sich und wandern dann aktiv in die Speicheldrüsen der Zecke ein, von wo sie bei der nächsten Blutmahlzeit mit dem Speichelsekret wieder in den nächsten Wirt gelangen können. Ein Teil der Arten wird auch auf die Zeckeneier übertragen, so daß die nächste Zeckengeneration schon von vorne herein infiziert sein kann.
Fast alle Rückfallfieber-Borrelien werden durch Zecken der Gattung Ornithodorus übertragen. Interessanterweise gehört zu fast jeder Ornithodorus-Art jeweils eine spezielle Borrelienart.
Abb. ## Ornithodorus moubata (Dieter Hassler, vorhanden)
Tabelle: Rückfallfieber-Borrelien und ihre Überträger
| Borrelia duttoni | Ornithodorus moubata | Zentralafrika |
| Borrelia hispanica | O. erraticus | Iberien, Nordafrika |
| Borrelia crocidurae | O. erraticus | Nordafrika |
| Borrelia merionesi | O. erraticus | Ägypten, Senegal |
| Borrelia microti | O. erraticus | Türkei, Kenia |
| Borrelia dipodilli | O. erraticus | Iran |
| Borrelia persica | O. tholozani | Asien bis Ägypten |
| Borrelia caucasica | O. verrucosus | Kaukasusregion |
| Borrelia latyschewii | O. tartakovskii | Iran, Zentralasien |
| Borrelia hermsii | O. hermsii | West-USA |
| Borrelia turicatae | O. turicata | Südwest-USA |
| Borrelia mazzoni | O. talaje | Süd-USA |
| Borrelia venezulensis | O. rudis | Zentral+Südamerik a |
| Borrelia coriacea | O. coriaceus | West-USA |
| Borrelia theileri | Rhipicephalus spp. | weltweit |
| Borrelia anserina | Argas spp. | weltweit |
| Borrelia recurrentis | Kleiderlaus! | Äthiopien |
Einige dieser Erreger sind für Menschen nicht pathogen (“krankheitsauslösend”), können aber in anderen Säugetieren Krankheiten verursachen. So ist Borrelia coriacea für Fehlgeburten bei Hirschen und Rindern verantwortlich, Borrelia anserina ist nur für Vögel pathogen.
Rückfallfieberborrelien besitzen die Fähigkeit, ihre Oberflächenstrukturen immer wieder zu verändern, so daß das Immunsystem sie nicht mehr wahrnimmt. Daher kommt es im Laufe der Erkrankung zu zahlreichen Rückfällen, für die jeweils eine neue Antigenvariante verantwortlich zeichnet. Wenn man so will, kann man dies als Tarnkappe betrachten, die dem Erreger ermöglicht, dem Immunsystem zu entgehen.
Daher sind üblicherweise sechs bis zehn fieberhafte Episoden, unterbrochen von Phasen relativer Beschwerdefreiheit, die Regel. Während der Fieberschübe, die meist drei bis fünf Tage dauern, wirkt der Patient schwerkrank, klagt über Muskel- und Gliederschmerzen, oft auch Übelkeit und Schwindel, Blutdruckabfall und beschleunigtem Herzschlag. Nach einem letzten hohen Fieberanstieg kommt es zur relativen Gesundung, der nächste Schub folgt meist nach etwa sieben Tagen.
Während der Fieberschübe lassen sich die Rückfallfieberborrelien oft in relativ hoher Zahl im Blut nachweisen. Gleichzeitig besteht oft eine Verminderung der Zahl der Blutplättchen (Thrombopenie). Etwa zwei bis drei Wochen nach Krankheitsbeginn können auch Antikörper nachgewiesen werden.
Grundsätzlich sind die selben Medikamente wie bei der Lyme-Borreliose wirksam. Geeignet im der Akutphase sind Tetracyclinpräparate oder Penicilline, die bei Bedarf auch intravenös verabreicht werden können. Ähnlich wie bei der Lyme-Borreliose kann zu Beginn der Therapie oft eine Herxheimer-Reaktion auftreten (siehe Lyme-Borreliose). Beim Läuse-Rückfallfieber war schon bei Gabe von Doxicyclin in Tablettenform die Herxheimer-Reaktion in einigen Fällen so heftig, daß die Patienten unter dem Bild einer Schocklunge starben. Deshalb hat man sich angewöhnt, die Dosierung des Doxicyclin mit maximal 50 mg zu beginnen und erst nach zwei Tagen auf die volle Dosis zu gehen.